近日,重慶大學醫學院王亞洲教授和生物工程學院尹鐵英教授團隊在工程化外泌體研究領域取得重要進展。該團隊面向中樞神經系統相關疾病(如阿爾茨海默病),提出了一種基于雜交細胞工程化定制多功能外泌體實現精準治療的新策略。相關研究成果以“Hybridoma-inspired strategy crafts tailored multifunctional exosomes for precision therapy”為題,長文在線發表于國際頂級刊物《美國科學院院刊》(PNAS)。
該成果由重慶大學研究團隊獨立完成,重慶大學2021級博士生董鑄峰為論文第一作者,醫學院王亞洲教授為論文的通訊作者,生物工程學院尹鐵英教授為論文共同第一作者和共同通訊作者。
外泌體(Exosomes)因其納米級尺寸效應與承繼來源細胞生物學功能的特性,在神經退行性疾病、腫瘤和心腦血管疾病等重大疾病的診療方面已展現出巨大的潛力。然而,外泌體功能化修飾面臨制備效率低、膜蛋白失活、膜結構破壞等局限,特別是對于非可傳代培養細胞(如NEs)來源外泌體的規模化制備尚無合適方法,這使得外泌體在臨床轉化過程中依然面臨著嚴峻挑戰。因此,進一步探索外泌體功能化修飾與規模化制備技術是亟待解決的關鍵問題。
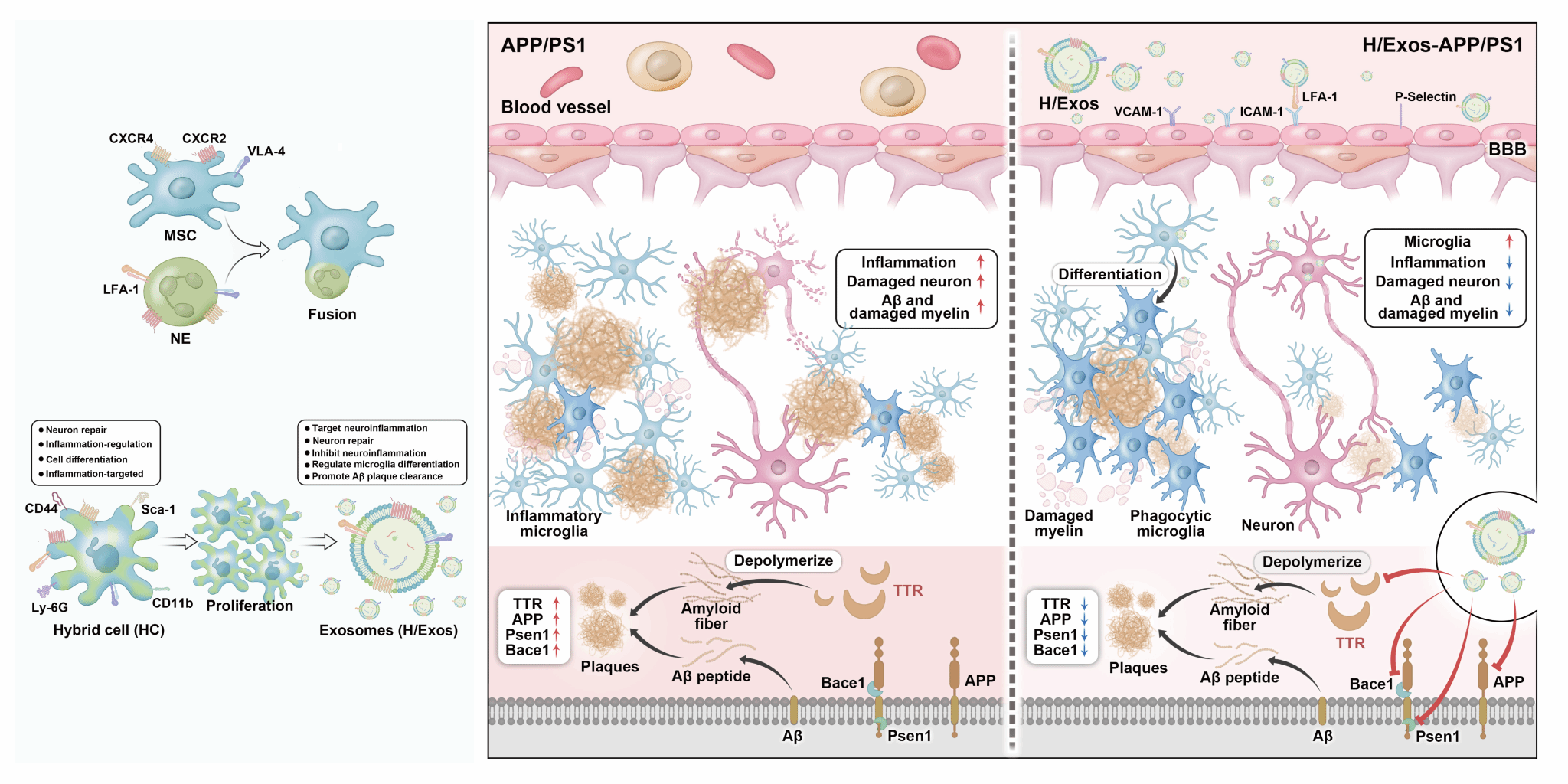
圖1. MSCs-NEs雜交細胞制備及其外泌體H/Exos精準治療阿爾茨海默病的相關機制
針對這一挑戰,研究團隊通過構建間充質干細胞(MSCs)與中性粒細胞(NEs)雜交細胞(圖1),證實了MSCs-NEs雜交細胞(HCs)兼具MSCs與NEs的生物學特性,且其外泌體H/Exos承繼了NEs快速炎癥響應與MSCs組織修復特性;經多次傳代培養后,HCs及其外泌體表型仍能維持穩定。在阿爾茨海默病(Alzheimer's disease,AD)動物模型中,研究團隊發現H/Exos能夠跨血腦屏障(BBB)精準快速炎癥響應,一方面通過調控小膠質細胞表型,顯著抑制神經炎癥反應并增強Aβ清除能力;另一方面通過修復溶酶體功能、改善線粒體穩態及神經元突觸可塑性,最終顯著改善AD模型小鼠的認知功能障礙(圖2)。
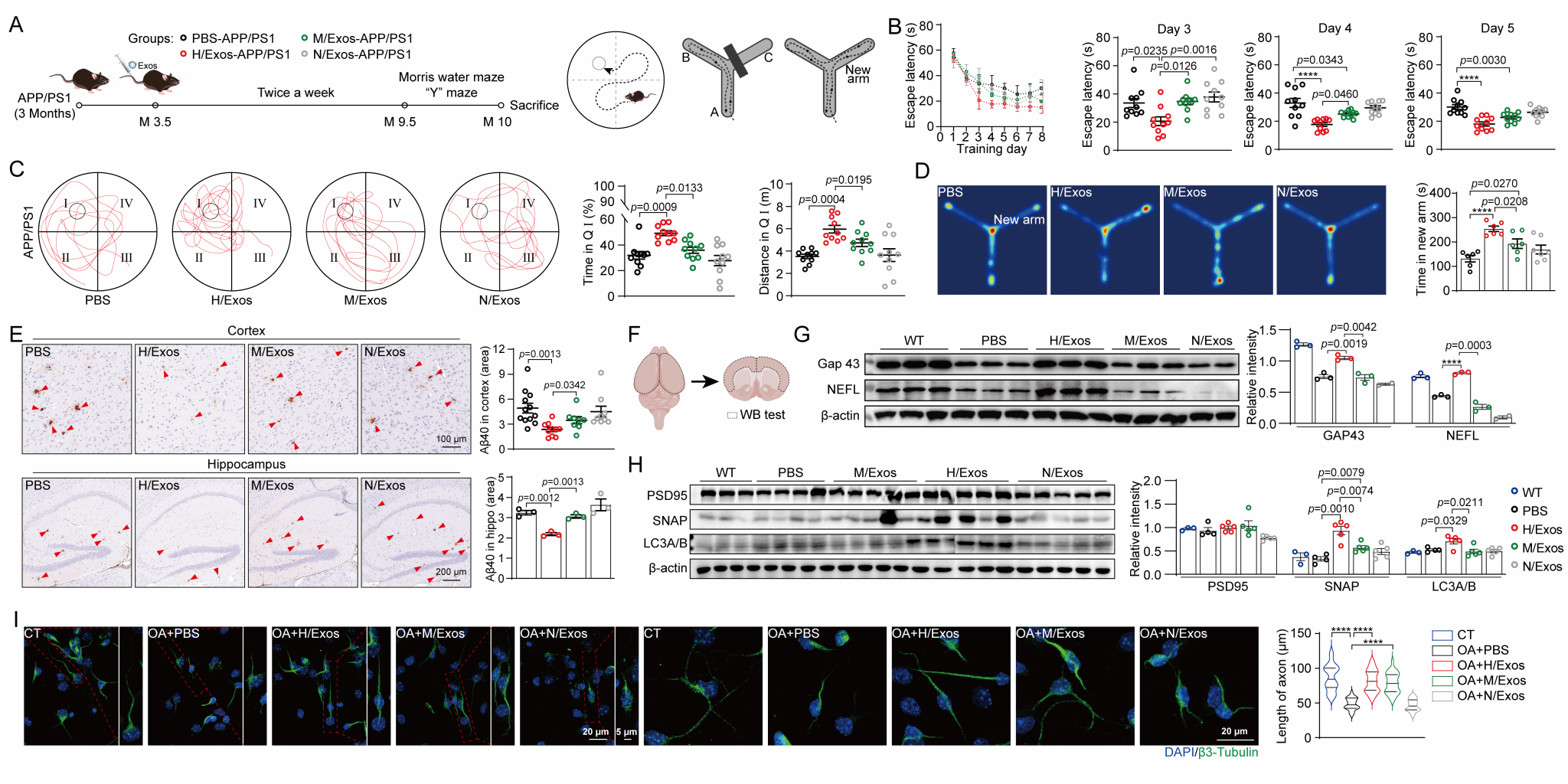
圖 2. 雜交細胞外泌體修復神經元損傷改善APP/PS1小鼠認知功能
該創新策略具有巨大的臨床轉化潛力,基于雜交細胞進行外泌體工程化修飾,不僅為模塊化、多功能外泌體的工程定制開辟了新的道路,可實現針對不同疾病類型、不同病患個體的不同雜交細胞組合實現疾病的個性化精準治療,也為非可傳代培養細胞來源外泌體的規模化制備提供了強大的技術平臺。
該工作得到了國家自然科學基金、重慶市自然科學基金和中央高校基本科研等項目的資助。
原文鏈接:https://www.pnas.org/doi/10.1073/pnas.2424547122
來源:醫學院